文章信息
文章题目:Discovery of deaminase functions by structure-based protein clustering
期刊:Cell
发表时间:2023年6月27日
主要内容:中国科学院遗传与发育生物学研究所高彩霞研究组,在Cell杂志上发表了文章Discovery of deaminase functions by structure-based protein clustering,该研究创新性地运用AI辅助的大规模蛋白结构预测,建立起全新的基于三级结构的高通量蛋白聚类方法,实现了脱氨酶功能结构的深入挖掘,鉴定到完全区别于已知脱氨工具酶的全新底盘元件,并成功开发了一系列具有我国自主知识产权的新型碱基编辑工具。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00593-7
使用TransGen产品:
TransDetect® PCR Mycoplasma Detection Kit (FM311)

研究背景
蛋白质是生命活动的主要承担者。通过对蛋白质进行功能聚类,是理解其参与的生理过程、设计新型蛋白质等的重要手段。现有的方法主要根据氨基酸一级序列的相似性对蛋白质进行聚类分析,并以此推断其功能和演化关系。但是,蛋白质功能由其三维空间结构所决定,开发基于三维结构的高通量蛋白质聚类方法,将为蛋白质的功能研究提供更直接、可靠的手段,并推动未知蛋白质的功能挖掘。
碱基编辑系统可以实现单核苷酸精度的DNA或RNA精准编辑,是基因功能研究、疾病治疗、生物育种的变革性技术。然而,现有碱基编辑系统的核心元件脱氨酶来源于单一家族,导致碱基编辑仍有诸多局限,编辑尚难以满足多元化的应用需求。而且,现有碱基编辑系统的底层专利由国外持有,我国亟需拥有具自主知识产权的碱基编辑系统。脱氨酶是碱基编辑系统的核心元件,因此,创新地挖掘新型脱氨酶,开发适用于不同应用场景的新型碱基编辑工具显得十分重要。
文章概述
首先,研究人员通过蛋白质结构预测模型AlphaFold2对具有代表性的脱氨功能序列进行批量三维结构预测,进一步创新性地开展了基于三维结构的蛋白质多重比对与聚类,成功将潜在的脱氨酶划分为20个不同的分支。除已报道的APOBEC/AID胞嘧啶脱氨酶外,研究人员又检测到了5个结构、序列全新的具有活性的胞嘧啶脱氨酶分支。在这些分支中,研究人员对具有类DddA(Double-stranded DNA deaminase toxin A-like)脱氨结构域的蛋白进行进一步结构聚类和功能验证,发现此前被认为具有双链DNA脱氨功能的DddA-like蛋白家族中的大部分蛋白其实只具有单链DNA脱氨的活性,该结果颠覆了之前对该类蛋白功能的认知。
以上研究表明,当蛋白集合的序列同源性较低且功能多样时,相比于传统的基于氨基酸一级序列的聚类方法,通过AI辅助的蛋白质结构聚类能够得到更准确的结果。因此,该方法为蛋白质功能分析和挖掘提供了一个高效、可靠的新策略。
随后,研究人员基于上述进一步聚类的结果,全新鉴定到45个单链胞嘧啶脱氨酶(Sdd)和13个双链胞嘧啶脱氨酶(Ddd)。这些脱氨酶是目前唯一全部来自于原核生物(细菌)的脱氨酶,而现有APOBEC/AID脱氨酶家族成员都来自于真核生物(主要包括人、哺乳动物或鱼类)。研究人员基于这些脱氨酶开发了一系列新型碱基编辑系统,并在动、植物细胞中进行了测试。结果表明,新开发的基于Ddd1和Ddd9脱氨酶的双链碱基编辑系统克服了常规编辑器对GC序列编辑效率明显降低的缺陷;基于Sdd7和Sdd3的单链碱基编辑系统展现出了非常高的编辑活性,在GC序列同样具有可观的碱基编辑能力;基于Sdd6的单链碱基编辑系统则展现出了极高的特异性,几乎检测不到脱靶事件。
进一步分析,研究人员通过蛋白理性设计和功能验证,开发了新型的可被单个腺相关病毒(AAV)包被的Sdd6-CBE碱基编辑器,在小鼠细胞系中成功获得高达43.1%的编辑效率, 解决了常规碱基编辑器过大而无法被腺病毒颗包被递送的难题。更重要的是,研究人员新开发的Sdd7-CBE系统,克服了大豆中长期存在的碱基编辑效率低下的问题,他们在154株大豆阳性苗中获得了34株稳定编辑的植株,编辑效率高达22.1%。这些脱氨酶是目前唯一全部来自于原核生物(细菌)的脱氨酶,而现有APOBEC/AID脱氨酶家族成员都来自于真核生物(主要包括人、哺乳动物或鱼类)。研究突破了现有脱氨酶的应用瓶颈,展现出新型碱基编辑系统在医学和农业方面广泛的应用前景。
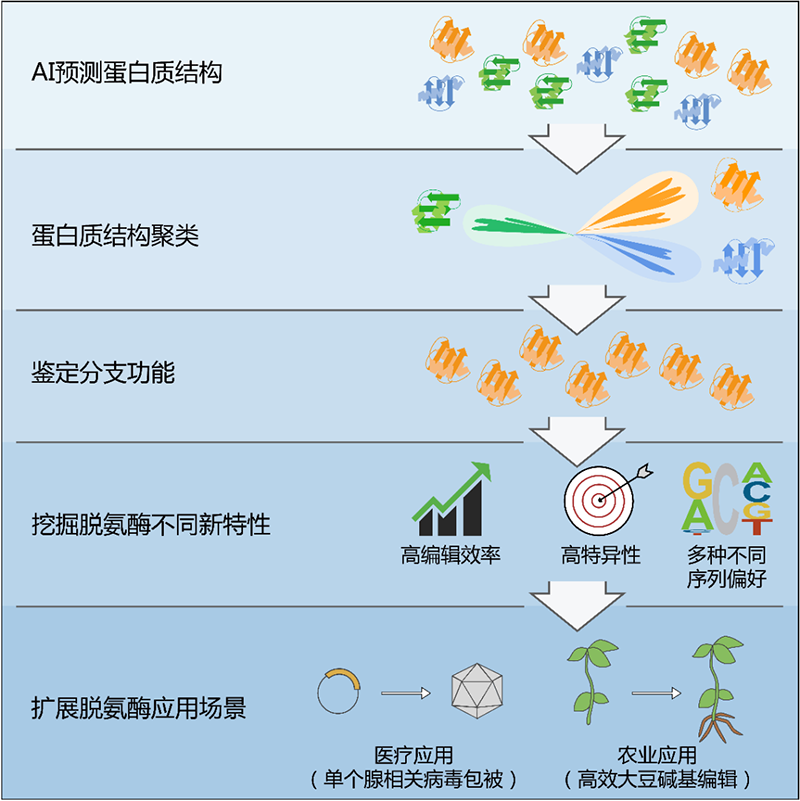
基于AI辅助的蛋白结构聚类挖掘脱氨酶并开发具有新特性的碱基编辑系统
综上,该项工作为蛋白功能分析、新功能元件挖掘提供了全新策略。新研发的碱基编辑系统是具有我国自主知识产权的精准基因编辑技术,有望打破碱基编辑底层专利垄断,将帮助我国在未来的生物技术产业竞争中处于有利地位。
全式金产品支撑
优质的试剂是科学研究的利器。全式金的PCR法支原体检测产品TransDetect® PCR Mycoplasma Detection Kit (FM311)助力本研究。
TransDetect® PCR Mycoplasma Detection Kit (FM311)
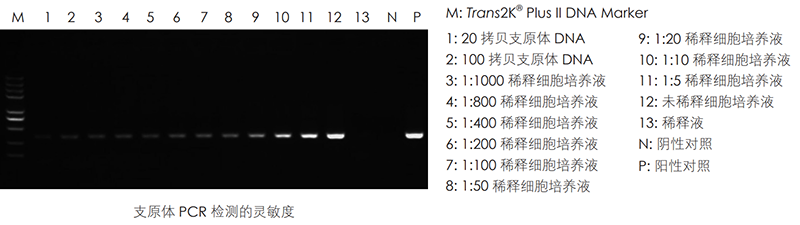
本产品通过PCR方法检测培养细胞等生物材料中的支原体,针对支原体16S rRNA序列保守区域设计特异引物,直接使用细胞培养液作为模板,特异性扩增支原体DNA,具有操作简便、快速(2小时内即可出结果)、特异性强、灵敏度高的特点。自上市以来多次荣登Cell、Nature等知名期刊,助力科学研究。
产品特点:
● 灵敏度高,可检测低至20个拷贝的支原体。
● 特异性强,只扩增支原体DNA,真核细胞和细菌DNA不被扩增。
● 操作简便,无需提取基因组DNA,适合大量细胞样品的检测。
● 配有阳性对照与阴性对照,保证PCR检测结果的准确性。
实验数据:
全式金产品再一次登上Cell期刊,证明了大家对全式金产品品质和实力的认可,也完美诠释了全式金一直以来秉承的“品质高于一切,精品服务客户”的理念。全式金始终在助力科研的道路上砥砺前行,希望未来能与更多的科研工作者并肩奋斗,用更多更好的产品持续助力科研。
使用TransDetect® PCR Mycoplasma Detection Kit(FM311)产品发表的部分文章:
• Huang J Y, Lin Q P, Fei H Y, et al. Discovery of deaminase functions by structure-based protein clustering [J].Cell, 2023.
• Lei Z X, Meng H W, Liu L L, et al. Mitochondrial base editor induces substantial nuclear off-target mutation [J]. Nature, 2022.
• Nian Z G, Zheng X H, Do Y C, et al. Rapamycin pretreatment rescues the bone marrow AML cell elimination capacity of CAR-T cells [J]. Clinical cancer research, 2021.
• Xu D C, Zhao H, Jin M Z, et al. Modulating TRADD to restore cellular homeostasis and inhibit apoptosis [J]. Nature, 2020.





